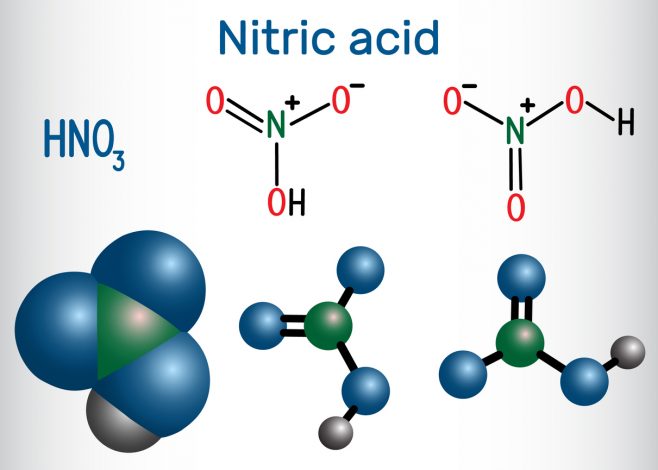
L’acide nitrique est un composé chimique dont la formule est HNO3. Autrefois, il était aussi appelé acide azotique ou encore « eau forte ». Cette substance se caractérise par sa forte acidité et sa décomposition rapide. A l’état pur, il est incolore et inodore. C’est un produit chimique de base, utilisé dans la fabrication de nombreux produits en laboratoire.
L’acide nitrique dans l’histoire
C’est l’alchimiste Jabir Ibn Hayyan qui a synthétisé l’acide nitrique pour la première fois au VIIIe siècle. Durant le XIIIe, Albert le Grand s’en est servi pour séparer l’argent et l’or. Ce ne sera que courant XVIIIe siècle qu’Antoine Lavoisier parvient à démontrer que ce liquide comporte de l’oxygène et de l’azote, une théorie confirmée un peu plus tard par Henry Cavendish.
L’acide nitrique n’a été utilisé dans les procédés industriels qu’à partir du XIXe siècle. Si au départ, on l’obtenait par distillation du salpêtre et de l’acide sulfurique, Frédéric Kuhlmann découvre en 1838 qu’il est aussi possible de l’obtenir par oxydation de l’ammoniac avec le platine.
Quelles sont ses propriétés ?
S’il se trouve à l’état pur, l’acide nitrique est incolore et inodore. S’il prend une teinte brune, il comporte des impuretés. S’il est chauffé à une température ambiante, il dégage une fumée jaune ou parfois rouge. Ce liquide est très oxydant. De ce fait, il peut avoir des réactions explosives s’il est mélangé à d’autres substances comme les poudres métalliques et les carbures.
Par ailleurs, en le mélangeant à des composés organiques comme l’essence de térébenthine, on obtient une solution auto-inflammable ou hypergolique. Étant un acide fort, il dissout complètement la plupart des métaux comme le zinc, le cuivre, le mercure, l’argent, le sélénium ou encore le nickel. Quant aux alcalino-terreux, ils sont dissouts complètement au contact de l’acide nitrique dilué, mais restent intacts si ce dernier est concentré.
Acide nitrique formule
On obtient l’acide nitrique dilué en mélangeant l’eau avec du dioxyde d’azote NO2. Si vous trouvez une solution liquide nommée « acide nitrique » dans un magasin spécialisé, il y a de fortes chances qu’elle contienne moins de 68% de la solution en réalité. Pour dégager de l’acide nitrique pur, il faut le distiller en présence d’acide sulfurique.
Les différents type d’acide nitrique
Dans le schéma de l’acide nitrique préparé en laboratoire, il existe généralement trois types d’acide nitrique. Ces types distincts d’acide nitrique sont définis par la concentration et les conditions de préparation. Le premier est l’acide nitrique à ébullition constante, d’une concentration de 68% et d’une gravité spécifique de 1,42. C’est l’acide du commerce et le plus facile à manipuler et à transporter. Il est dit à ébullition constante car, à cette concentration, l’eau et l’acide nitrique forment un azéotrope binaire qui bout toujours à la même température. En termes simples, l’acide nitrique à 68 % peut être bouilli à la pression atmosphérique et les vapeurs condensées sans changement.
Les deux types suivants sont les acides nitriques fumants. Ils sont appelés ainsi en raison des fumées abondantes et étouffantes qu’ils dégagent. Ces formes d’acide nitrique sont non seulement plus concentrées, mais aussi beaucoup plus réactives. Il s’agit d’acides nitriques fumant blanc et fumant rouge. Tous deux ont une concentration d’environ 95+% et une gravité spécifique de 1,52. L’acide nitrique de cette concentration a davantage les propriétés d’un oxydant fort que celles d’un acide. L’acide nitrique fumant blanc est obtenu par distillation de nitrates de métaux alcalins ou d’acide nitrique à ébullition constante avec de l’acide sulfurique concentré à pression réduite. La distillation de ces mélanges à la pression atmosphérique produit de l’acide nitrique fumant rouge. Il s’agit d’acide nitrique dans lequel est dissous du dioxyde d’azote rouge brunâtre qui donne à l’acide sa teinte caractéristique brun rougeâtre.
Acide nitrique à 70
À cette concentration, l’acide nitrique est considéré comme étant de qualité technique. L’acide nitrique 70% est un bon oxydant qui est utilisé pour le nettoyage des bijoux en or et en argent. Il est également utilisé pour le décapage des métaux et le nettoyage général.
Acide nitrique 90% à fumée jaune
L’acide nitrique 90% est également connu sous le nom d’acide nitrique fort, il est principalement utilisé comme réactif de laboratoire, engrais et matériau pour l’industrie des explosifs. Cette forte concentration d’acide nitrique est principalement utilisée comme réactif pour l’azote, oxydant fort et combustible pour fusées.
Remarque : Ces produits et produits chimiques sont destinés à être utilisés pour la recherche, les travaux industriels, le nettoyage ou la désinfection et doivent toujours être stockés hors de portée des jeunes enfants ou des nourrissons.
Quelles sont ses utilisations possibles ?
L’acide nitrique est très présent dans de nombreuses industries et processus. Des brevets sont régulièrement déposés pour de nouvelles utilisations de l’acide nitrique. Voici un guide des principales utilisations actuelles de l’acide nitrique :
L’acide nitrique est surtout utilisé comme réactif de laboratoire. Ses utilisations sont nombreuses, dont les principales sont :
- La fabrication d’engrais
La principale utilisation industrielle de l’acide nitrique est la production d’engrais. Combiné à l’ammoniac, l’acide nitrique donne un excellent engrais sous forme de nitrate d’ammonium. Un autre engrais fabriqué est le nitrate de calcium. Ces engrais sont utilisés dans les fermes de tout le pays.
- La fabrication d’explosifs
L’acide nitrique est utilisé pour créer différents types d’explosifs comme la nitroglycérine et la trinitroglycérine (TNT). Ces explosifs sont de qualité militaire et sont utilisés pour la défense nationale.
- La fabrication de produits photographiques et pharmaceutiques
Dans sa forme pure, avec sa nature caustique, l’acide nitrique peut être utilisé pour enlever les verrues et les furoncles. S’il est dilué, il peut être utilisé pour traiter les indigestions.
- La fabrication de colorants
Lorsque l’acide nitrique est transformé en nitrate d’ammonium calcique, les fabricants peuvent l’utiliser pour traiter un certain nombre de colorants commerciaux.
- L’industrie textile et les réactifs analytiques
- Gravure
Lorsque l’acide nitrique est combiné à de l’alcool, il peut être utilisé pour graver des motifs sur divers métaux comme le cuivre, le bronze et le laiton. Ces motifs sont généralement utilisés dans la décoration intérieure.
- Adhésif
L’acide nitrique est un composant courant d’un adhésif utilisé dans les emballages alimentaires et les cartons.
- Détection des drogues
L’acide nitrique peut être utilisé dans un test colorimétrique pour détecter la différence entre l’héroïne et la morphine. Il est également important dans les tests ponctuels qui permettent d’identifier le LSD.
Par ailleurs, étant donné qu’il réagit avec quelques métaux, on s’en sert également dans l’industrie métallurgique et dans le domaine de la microélectronique. Il faut toutefois noter que l’acide nitrique nécessite de prendre des précautions car il peut causer de graves brûlures sur la peau. A cause de son oxydation et de son inflammabilité, il ne faut surtout pas porter des gants en nitrile ou en latex quand vous vous en servez. C’est une des raisons pour laquelle les sites professionnels n’acceptent d’en vendre qu’à des usines.
L’acide nitrique peut être utilisé pour purifier et nettoyer les métaux nobles comme le platine, l’or et l’argent. Il forme de l’eau régale lorsqu’il est combiné à l’acide chlorhydrique, qui peut même dissoudre l’or et le platine. Les métaux nobles sont généralement purifiés par les bijoutiers.
Le nettoyage de certaines surfaces nécessite l’utilisation des acides comme l’acide sulfurique ou encore l’acide nitrique. L’acide nitrique possède une propriété très corrosive, il faut faire attention à ce qu’elle ne touche pas les métaux tels que le cuivre. Par la suite, privilégiez la manipulation du plastique ou du verre si vous voulez intégrer l’acide nitrique dans les travaux de maison.
Les professionnels en bâtiment peuvent utiliser l’acide nitrique pour décaper de la peinture, des aciers inoxydables ou du vernis sur des surfaces.
Quels sont les dangers de l’acide nitrique ?
Lorsque vous manipulez de l’acide nitrique sur votre lieu de travail, nous vous recommandons fortement de porter des lunettes de protection contre les produits chimiques, un écran facial pour vous protéger des éclaboussures, des gants et un appareil respiratoire à vapeur approuvé si une ventilation adéquate n’est pas disponible.
En cas d’exposition à l’acide nitrique, suivez ces directives de premiers soins :
Inhalation – Cherchez de l’air frais et une assistance médicale immédiate.
Contact avec les yeux – Rincer immédiatement les yeux à grande eau pendant au moins 15 minutes pour éviter d’autres dommages, et consulter immédiatement un médecin.
Contact avec la peau – Rincer immédiatement la zone affectée avec beaucoup d’eau pendant au moins 15 minutes. Enlever les vêtements contaminés et se laver avec du savon. Des soins médicaux immédiats sont nécessaires.
Ingestion – Ne PAS provoquer le vomissement. Rincer la bouche avec de l’eau et donner un verre d’eau ou de lait. Ne jamais rien donner par la bouche à une personne inconsciente. Consulter immédiatement un médecin.
Où s’en procurer ?
Le moyen le plus rapide de trouver de l’acide nitrique, c’est de taper acheter acide nitrique dans votre navigateur. On vous donnera ainsi une liste de tous les professionnels qui la mettent en vente. Sinon, vous pouvez aussi vous en procurer chez un grossiste de produits chimiques. Prêtez toujours attention à la concentration d’acide nitrique contenue dans la solution pour l’adapter à vos besoins. Dans tous les cas, faites preuve d’une grande prudence pour manipuler ce liquide, qu’il soit dilué ou concentré et laissez-le hors de portée des enfants.
Comment savoir quelle concentration d’acide nitrique est la bonne pour vous ?
Lorsque vous achetez de l’acide nitrique, vous constatez qu’il est proposé dans une variété de pourcentages différents. Mais que signifient ces pourcentages ?
La qualité commerciale, qui correspond à la qualité moyenne, est généralement constituée de solutions d’acide nitrique dont la concentration se situe entre 52 % et 68 %, le reste étant de l’eau.
Les laboratoires ont besoin d’une qualité supérieure et leurs concentrations sont généralement comprises entre 70 % et 99 % d’acide nitrique. Lorsqu’une solution est composée de plus de 86 % d’acide nitrique, on parle alors d’acide nitrique fumant. Lorsqu’elle atteint des concentrations supérieures à 98 %, elle peut être divisée en deux catégories distinctes : l’acide nitrique fumant blanc et l’acide nitrique fumant rouge.